

























随着国家鼓励新药研发、药品审评审批制度改革的快速推进,化药注册分类、上市许可持有人制度等重磅政策的陆续出台,我国新药研发迎来暖春。对于力图在创新药领域深耕的从业者而言,如何洞悉全局,乘势而为,或将成为未来成败的关键。
为此,广州九游会J9医药微信公众号特邀生物分析专家、九游会J9医药子公司深圳博瑞副总经理袁智博士,开设“袁来如此”专栏,就大分子生物分析、药代动力学等相关话题展开专题研究,希望通过相关知识与经验的分享,引发更多读者的讨论交流,加速振兴中国的生物医药产业发展,敬请垂注!
本文为“袁来如此”专栏的第一篇,旨在根据已发表的文献资料,对与大分子生物分析相关的知识进行系统地介绍。
配体结合式测试方法(LBA,也称为immunoassays)是一种常用的分析工具,用于根据与其他生物分子的相互结合作用(binding interaction),定量测定生物分子(目标分析物,Analyte)在生物体液中的浓度。LBA要求至少使用一个生物分子来定量目标分析物,这个生物分子通常被称为关键试剂,须能够特异性地结合目标分析物。
LBA可分为两大类:(1)液相结合测试,其目标分析物与标记过的检测试剂之间的结合反应发生在溶液相(图1A);(2)固相结合测试,其中一个关键试剂被固定到固体表面,如微孔板或树脂(图1B),以捕获样本中的目标分析物。液相测试通常需要分离步骤,如色谱或电泳或离心,从而将目标分析物-标记检测试剂从未结合的分子中分离出来进行定量。
在应用上,LBA是重要的评估生物药PK/TK时的主要定量分析方法之一,该方法的特异性和选择性取决于目标分析物与其他生物分子(如受体、针对候选生物药的抗体和核酸适配体(aptamer))的相互作用。
该方法中可观察到仪器响应与生物药的浓度间接相关,简言之,检测信号的来源是酶化学反应或放射化学反应,而这些反应则是各种相互结合作用(binding interactions)的一部分。
一般而言,大分子的物理化学特性无法直接产生检测信号,不能用于这样的定量分析方法。主要原因在于这些binding interactions的内在性质,LBA的标(校)准曲线的动态(定量)范围比较狭窄,同时也是非线性,S型的(sigmoidal curve)。

如图1所示,在液相测试中,结合反应在溶液中发生,其中一个目标分析物与标记过的检测试剂结合,然后再通过后续的分离操作将目标分析物-标记检测试剂从未结合的分子中分离出来。
在固相测试中,一个关键试剂被固定到固体表面,如微孔板或树脂,此试剂在固体表面结合目标分析物,从而致使未结合的分子被分离出来。
Yalow和 Benson于1960年开发的测定人类胰岛素的方法,是放射免疫测定(RIA)的标志性例子,Yalow因此于1977年获得诺贝尔奖。简单地说,就是通过用鱼精蛋白锌牛胰岛素或商业常规牛胰岛素免疫豚鼠,以获得作为该RIA方法关键试剂的胰岛素结合抗体。
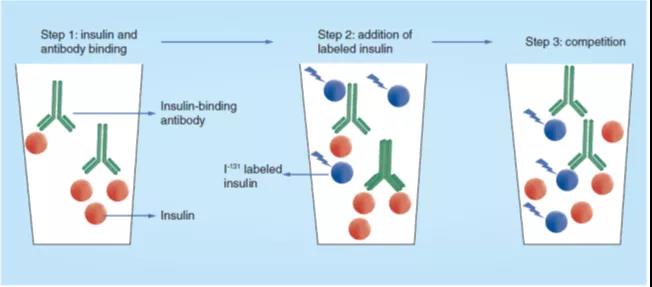
在这种方法中,由于缺乏人类胰岛素的结晶体,因此I131标记的结晶牛胰岛素(胰岛素-I131)被用作示踪剂。此 RIA 的原理是基于样本中的人胰岛素与豚鼠血清中的胰岛素结合抗体的强力结合(图2中的步骤1),并让已知浓度的胰岛素-I131与该抗体的结合竞争(图2步骤2-3)。胰岛素-I131与胰岛素结合抗体的结合在溶液中进行,游离的胰岛素-I131与结合了抗体的胰岛素-I131的分离通过纸色谱电泳技术实现,这就使得定量测定胰岛素-I131成为可能,其代表了样本中胰岛素的浓度。在此方法中,最低可定量的胰岛素浓度为1.4μU。
在这个有里程碑意义的研究发表之后,RIA在20世纪后期得到了广泛的应用。在使用适当的关键试剂时,RIA灵敏度和选择性都极高,而其主要挑战包括使用和处置放射性材料的许可证要求、放射性同位素的标记效率、成本及其有限的半衰期。在RIA得到应用的十年内,即20世纪的70年代初,就出现了非同位素免疫测定,如酶免疫测定(enzyme immunoassays,EIA),EIA通常被称为ELISA,即酶联免疫吸附试验(enzyme linked immunosorbent assay)。
Engvall和Perlmann在1971年首次描述了一个定量兔免疫球蛋白G(兔IgG)的ELISA方法。其实质就是从羊血清中提取的抗兔IgG用于结合兔子IgG,进而结合了一种碱性磷酸酶(ALP)的兔IgG被用来与兔IgG相互竞争和抗兔IgG血清的结合,以此建立浓度与仪器响应(信号)之间的关系,生成的仪器信号与样本中的IgG量成反比。随着技术的不断发展,学界运用了不同的酶,如辣根过氧化物酶(HRP)、β-半乳糖苷酶(GAL)和荧光素酶(luciferase),使得EIA具有与RIA相当的灵敏度。
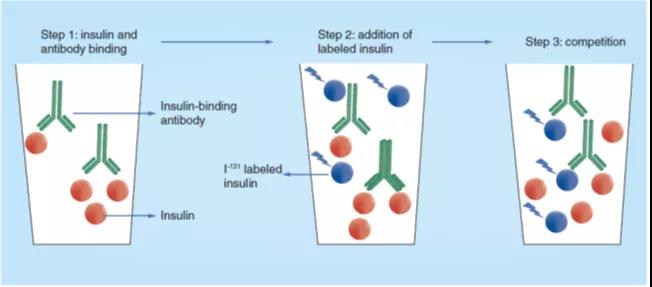
图 2. Yalow最初发明的胰岛素放射免疫测定的原理图。样本中的胰岛素在溶液中与抗胰岛素血清结合(步骤1),然后把已知浓度的I131标记的牛胰岛素添加到反应溶液中(步骤2),样本中的胰岛素与I131标记的牛胰岛素(步骤3)相互竞争与抗体的结合。使用人胰岛素制备的标准曲线以及胰岛素抗体结合的I131标记牛胰岛素的浓度可以计算样本中被置换的胰岛素的浓度。
竞争式ELISA格式是基于初始的胰岛素RIA和IgG EIA方法中的结合竞争。来自样品的目标分析物(analyte)和参照分析物(reference analyte)与分析物特异性的抗体结合之间的竞争是这种格式的关键。
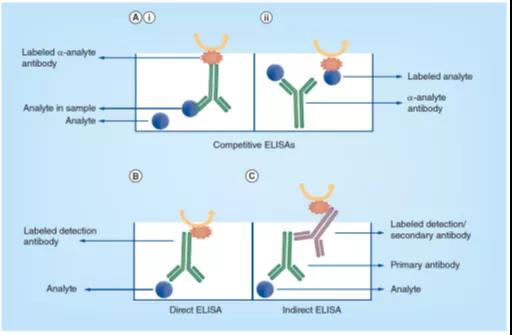
抗体或目标分析物都可以标记酶,并用于结合反应。使用标记抗体(图3Ai)时,参照分析物首先被动地吸附到微孔板的孔中,然后加入含有目标分析物的样本,如细胞裂解液、血清等,并与固定浓度的标记抗体一起孵育。样本中的目标分析物与固定的分析物竞争,以结合有限数量的标记抗体,随后的酶反应产生的信号与样本中目标分析物的浓度成反比。或者,可以使用固相吸附的抗体和标记分析物(图3Aii),样本中的目标分析物与固定数量的标记分析物共同孵育,并与之相互竞争和固定抗体的结合。与前面的示例中一样,生成的信号与样本中目标分析物的浓度成反比。
直接式ELISA是最简单的ELISA格式,样品中的目标分析物吸附到微孔板的孔中,通过酶偶联试剂或标记检测抗体,直接实现目标分析物的检测,如图3B所示。
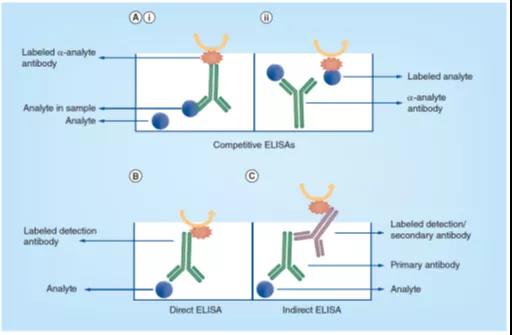
图3. 竞争式(Ai & Aii)、直接(B)和间接(C)ELISA测试格式的原理图。目标分析物(Analyte)代表被测定的目标蛋白质。在竞争式ELISA中,可以标记目标分析物或抗体,而在直接或间接ELISA格式中,只标记检测抗体。
间接ELISA类似于直接ELISA,两者间主要差别在于主要(primary)抗体未被标记。目标分析物的检测是通过再次添加一个酶偶联试剂或标记检测抗体,使其与主要抗体结合而实现的,如图3C 所示。
直接ELISA更快速,因为它比间接ELISA少一个步骤。它通常用于需要快速完成的常规测试,商业化的家用怀孕测试就是这种格式的一个例子。而间接ELISA虽然较直接ELISA多一个步骤,但信号放大通常优于直接ELISA。因此,间接ELISA通常比直接ELISA更敏感,可以测量更低丰度的蛋白质。
正如图3C 所示,间接ELISA较直接ELISA增加的步骤正是来自于样本的目标分析物直接吸附到微孔板,但想要达到这样的效果,亦有一定的难度。因为在洗板步骤中,可能会洗掉目标分析物,因此可能会增加测试的变异性。此外,非特异性地结合到微孔板的其它蛋白可能导致假阳性结果。为了克服上述挑战,其它可靠性更高的格式进而衍生出来,其中有通常被称为夹心、桥联或竞争性ELISA(在夹心或桥联ELISA格式中),在这些格式中,一种能与目标分析物特异性结合的生物试剂首先被吸附到微孔板中。
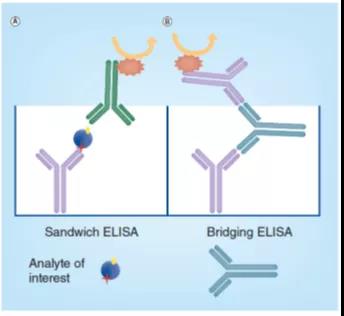
图4. 夹心式ELISA(A)和桥接式(B)ELISA的原理图
夹心式ELISA需要两个不同的试剂或抗体,一个用于捕获,另一个用于检测目标分析物。这些试剂与目标分析物的不同表位(epitopes,结合位点)结合,从而形成夹心式格式(图4A),由此产生的相互作用具有特别高的特异性(因为捕获和检测步骤都需要特异的表位识别,才能生成检测信号)。
桥联ELISA常用于测定具有两个相同抗原结合位点(2价)的抗体或其它目标分析物的浓度,可以标记与捕获相同的试剂,用于检测一个二价的目标分析物,因此,目标分析物可被视为捕获和检测试剂之间的桥梁(图 4B)。夹心或桥接ELISA 格式均可设计成为竞争式的ELISA。
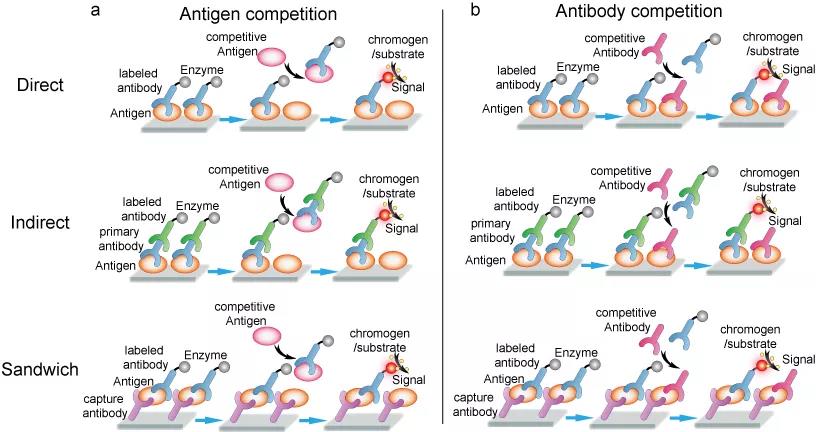
上述格式是ELISA的基本设计,所有格式都可以使用竞争或抑制条件加以调整,来测定抗原或抗体(图5),所有方法都要求与试剂预先反应/孵育才能达到最佳状态。这些最佳状态可以通过添加抗原(图5a)或抗体(图5b)来给予挑战。随着溶液中游离的抗原(抗体)的增加,能够与固定底物(immobilized substrate)结合的抗体(抗原)的数量则减少。洗涤步骤后,添加生色剂底物(chromophore substrate)以产生信号(颜色变化或发光)。抗体/抗原挑战引起的信号变化揭示了有关竞争性抗原/抗体的信息。竞争式ELISA对于测定复杂混合物中的抗原浓度相当有用,特别是在可能含有抗原的未知样品与含有已知数量的纯化抗原的类似样品时。
免疫表位(epitope)是宿主免疫系统一般能够识别的抗原分子的一部分。当抗原的表位以非共价键的形式与其所诱导产生的抗体的确定互补性的区域(complementarity determining region)相互作用时,就会发生特异性的识别。
抗体亲和力(affinity)表示抗体与其单一目标分析物(analyte)/抗原(antigen)结合的烈度(intensity)或强度(strength),由解离常数(Kd)代表。低亲和力抗体与抗原结合弱,容易解离;而高亲和力抗体与抗原结合非常强,在多次的洗涤步骤中不易解离。从ELISA的角度来看,后者是首选,通常用于捕获目标分析物。
亲和度(Avidity)是衡量一个抗体与多个抗原决定因子(antigenic determinants)结合的整体强度的指标。抗体对某一个结合位点的亲和力并不总是能反映抗体-抗原相互作用的强度,例如免疫球蛋白G(IgG)有两个抗原结合位点(2价),而IgM有10个抗原结合位点(10价),亲和度表示IgG或IgM的,分别对于2个或10个抗原分子的整体结合强度(overall strength)。
关键试剂
一个ELISA方法最重要的组成部分是测试试剂,它决定了ELISA方法的灵敏度、特异性和方法的质量。ELISAs常用于药物开发:在PK评估中,定量测定蛋白生物药的浓度;测定内源性蛋白和生物标志物;检测抗药物抗体的存在以进行免疫原性评估等。LBA方法首选的关键试剂是单克隆抗体(MAbs)或多克隆抗体(PAbs),而不是重组靶标蛋白。为了产生PAbs或MAbs,需要将生物药或生物标志物蛋白及其佐剂或载体,根据相关应用给到合适的宿主动物物种上进行免疫。对于PAbs,兔子、山羊和绵羊是最常用的宿主物种,因为它们的体型大(产生的抗体量也大),容易找到血管和强健的免疫反应。
用于免疫的每一个抗原都是高度复杂的,因为它可以呈现大量的,可以被不同的淋巴细胞识别的表位,这些淋巴细胞随后被激活。激活了的淋巴细胞增殖,分化成浆细胞,并分泌出多克隆抗体的混合体。PAb库(混合体)代表了不同抗体的集合群体,这些抗体可以识别抗原的多个表位(用于ELISA分析)。为了生产MAbs,需要进一步分离单个淋巴细胞,并与骨髓瘤细胞融合,以产生不死的杂交瘤细胞,从而持续产生特定的MAb。因此,同一个克隆(clone)的抗体只识别一个抗原的单个表位。在ELISA中会频繁使用MAbs或PAbs,其选择(对于每种ELISA格式而言)取决于许多考虑因素:如可及性(Availability)、亲和力、特异性(Specificity)和交叉反应性(Cross-reactivity)。
抗体的特异性(specificity)是特异性地结合相关抗原的能力,与ELISA方法的选择性(selectivity)不尽相同,但相关。选择性是一个定量分析方法,在其它潜在干扰成分存在的情况下,从众多其它无关的蛋白质中鉴别和定量测定目标分析物浓度的能力。交叉反应性(cross-reactivity)是指抗体与除目标抗原之外的其它多个抗原结合的能力。当抗原(目标分析物)的与抗体试剂结合的表位与其它蛋白质相似时就会发生交叉反应。一般来说,特异性和交叉反应性对ELISA方法的选择性和基质效应有很大影响。如果使用高亲和力抗体作为捕获试剂,抗体/目标分析物的复合物就能够在含有多种蛋白质的“混合物”样品中有效地形成,基质效应会随之降低,而方法的选择性最终会得到提升。
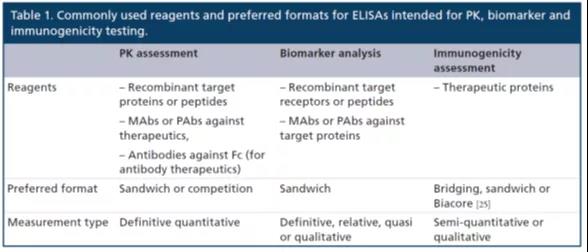
表1总结了ELISA可能用到的试剂和各种通用或首选格式。
测试试剂的可及性可能因药物开发的不同阶段而异。在早期探索阶段,可能无法得到MAbs或PAbs,故常常选择重组生产的配体(即生物药的靶点)作为关键试剂来测定游离的蛋白生物药(therapeutic protein,TP)的浓度。在早期临床前研究中,针对IgG Fc部分的通用抗体可用于单克隆抗体药物,尽管仅能测定总浓度(结合靶标后的TP +游离的TPf)。
生物标志物的定量分析方法
各种体外诊断试剂盒在商业上可用于药物的早期发现阶段,也可从不同的供应商获得各种重组蛋白和抗生物标记物蛋白的抗体。虽然生物标记物的定量分析方法与PK方法相似,但这二者之间存在明显差别。与PK方法类似,生物标志物的定量分析方法可用于测定目标基质中生物标志物蛋白的游离浓度或总浓度。夹心式测试格式是主要选择,通常用于测定生物标志物蛋白的游离或总浓度。虽然当一个生物药具有抑制作用时,需要测量游离的生物标志物蛋白浓度,但开发测定游离的生物标志物蛋白的方法有相当的挑战性,可能需要额外的分离步骤。
人源化的或全人源的单克隆抗体或重组蛋白,作为药物给予受试者/动物后,可诱导形成针对该生物药的抗体,特别是在临床前的动物试验中,这些由生物药诱导而形成的抗体通常被称为抗药物抗体(ADA)。免疫检测方法是检测ADA是否存在于血清中的第一级检测。不同的ADA反应,如表位特异性(idiotype vs. nonidiotype,特异与非特异性)和数量(滴度或相对浓度),会影响对ADA和生物药的准确定量。由于ADAs会在血液循环中与生物药形成免疫复合物,高浓度的蛋白生物药能够干扰ADA的检测。
备注:idiotype:免疫球蛋白(如IgG)可变区域的分子结构和构象,赋予其抗原特异性。
LBA测试方法在各种生物分子的定量分析方面拥有各种优势。它们在大多数平台(如比色计或平面电化学发光)上,成本通常很低。当高亲和力MAbs用于LBAs时,LBA方法在检测和定量分析存在于异质性的基质环境中的目标分析物方面,具有高度灵敏度和特异性。出于研究目的,该类方法的灵敏度可以低至每毫升毫微微克的级别(femtogram/mL)。大多数LBAs的操作程序不涉及样品分离的步骤,而基于LC-MS/MS的定量分析方法则需要。当然,LBA也有几个缺点,与LC-MS/MS方法相比,LBA方法的动态范围较狭窄。虽然用于基础研究的方法可以达到4-6个指数级的动态范围,但用于规范性研究(regulated study)的验证过的方法,其定量范围往往仅为2-3个指数级,这是因为必须保持方法的稳健性和更好的重现性。
最重要的区别是,LBA的性能取决于所使用试剂的质量和特异性。因此,试剂生成/选择(MAbs或PAbs)是方法开发过程中的关键步骤,这可能非常耗时,3到9个月不等。当使用分析物特异性的试剂来捕获目标分析物时,这个缺点对LC-MS/MS方法也是存在的。从生物标志物方法的角度来看,试剂的交叉反应可导致该方法的非特异性。因此,强烈建议进行额外的测试以阐明试剂的交叉反应性和非特异性。
本文概述了LBA测试方法,包括其主要概念的起源和演变,并且回顾了常用的大分子生物分析方法的测试格式。最初的LBA测试方法诞生于1960年,是为测定胰岛素而开发的放射免疫测试(radioimmunoassay),LBA测试方法的基础是至少有一种蛋白质与感兴趣的目标分析物有相互作用。在当今的实验室, 酶免疫测试(enzyme immunoassay)已在很大程度上取代了放射性免疫测试,成为了LBA测试方法的首选形式。
此外,本文还介绍了其它各种测试格式,如竞争式(competitive)、夹心式(sandwich)和桥接式(bridging),以及其所需的关键试剂。最后,简明扼要地讨论了LBA测试方法在蛋白质生物药开发中的应用,以及与其它生物分析平台的比较。
自上世纪60年代对胰岛素进行定量测定以来,基于与其它生物分子结合作用的LBA方法已被广泛地用于生物分子的定量分析。例如,在蛋白质生物药开发过程中,这些方法为定量分析或检测蛋白质提供了一种准确和经济有效的方法。测试试剂(MAbs或PAbs)生成/选择是LBA方法开发过程中的关键步骤,一旦选择好了试剂,不同测试平台上的LBA方法能够提供显著节约时间和经济成本。
如前所述,另一个主要的大分子生物分析平台是液相色谱-质谱(LC-MS/MS)。在小分子药物的生物分析中,LC-MS/MS方法是毋庸置疑的王者,在大分子分析中,LC-MS/MS的重要性也在不断地增加,特别是在与LBA方法以某种形式组合之后。可以肯定,生物分析业界将继续探索LC-MS/MS在蛋白质药物的生物分析中的应用。生物分析行业必须证明LC-MS/MS在药物开发的整个过程中,与LBA方法相比较,具有重现性(reproducibility)、可转移性(transferability)、可靠性(reliability)和成本效益(cost–effectiveness)等方面的显著优势。本系列后续将介绍相关知识,敬请关注。
本文来源:生物制药小编
本文如有疏漏和误读相关指南和数据的地方,请读者评论和指正。所有引用的原始信息和资料均来自已经发表学术期刊、官方网络报道等公开渠道, 不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备。欢迎读者提供有价值的文献及其评估。
1. Thway TM. Fundamentals of large-molecule protein therapeutic bioanalysis using ligand-binding assays. Bioanalysis (2016) 8(1), 11–17
2. Yalow RS, Berson S A. Immunoassay of endogenous plasma insulin in man. J. Clin. Inv. 39, 1157–1175 (1960).
3. Moss AJ, Dalrymple GV, Boyd CM. Practical Radioimmunoassay. The C.V Mosby, St. Louis, MO, USA (1976).
4. Jaffe BM, Behrman H. Methods of Hormone Radioimmunoassay. Academic, New York, NY, USA, (1979).
5. Travis JC. Fundamentals of RIA and Other Ligand Assays. Scientific Newsletters, Anaheim, CA, USA (1979).
6. Engvall E. Enzyme immunoassay ELISA and EMIT. In: Methods in Enzymology Volume 70. van Vunakis H, Langone J (Eds). Academic, New York, NY, USA, 419–439 (1970).
7. Engvall E, Perlmann P. Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G. Immunochemistry 8, 871–874 (1971).
8. Jenkins R, et al. “Recommendations for Validation of LC-MS/MS Bioanalytical Methods for Protein Biotherapeutics.” The AAPS Journal1 (2015): 1–16. PMC. Web. 13 Apr. 2016
9. Gao XL, et al. Quantitative analysis of factor P (Properdin) in monkey serum using immunoaffinity capturing in combination with LC–MS/MS. Bioanalysis, March 2016,Vol. 8, No. 5, Pages 425-438 , DOI 10.4155/bio.15.258
10. Zhang YJ, et al. The integration of ligand binding and LC-MS-based assays into bioanalytical strategies for protein analysis. Bioanalysis July 2014 ,Vol. 6, No. 13, Pages 1827-1841 , DOI 10.4155/bio.14.128 (doi:10.4155/bio.14.128)
11. Van Dyke K. Biolumisencence and chemiluminescence: instruments and applications, vol I/II. CRC Press, Baton Roca, FL, USA (1985).
12. Schaap AP, et al. Chemiluminescent substrates for alkaline phosphatase: application to ultrasensitive enzyme-linked immunoassays and DNA probes. Clin. Chem. 35(9), 1863–1864 (1989)
13. Stanley PE, Kricka LJ. Bioluminescence and Chemiluminescence, Current Status. Wiley, New York, NY, USA (1991).
14. Lipman NS, et al. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR J. 46(3), 258–68 (2005).
15. DeSilva B, et al. Recommendations for the bioanaltyical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules. Pharm. Res. 11, 1885–1900 (2003).
16. Lee J, Ma H. Specificity and selectivity evaluations of ligand binding assay of protein therapeutics against concomitant drugs and related endogenous proteins. AAPS J. 9(2), e164–e170 (2007).
17. Lee JW, et al. Bioanalytical approaches to quantify “total” and “free” therapeutic antibodies and their targets: technical challenges and PK/PD applications over the course of drug development. AAPS J. 13(1), 99–110 (2011).
18. Shih JY, et al. Implementation of a universal analytical method in early-stage development of human antibody therapeutics: application to pharmacokinetic assessment for candidate selection. Bioanalysis 4, 2357–2365 (2012).
19. Lee JW. Method validation and application of protein biomarkers: basic similarities and differences from biotherapeutic. Bioanalysis 1, 1461–1473 (2009).
20. Shankar G, et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. JPBA 15(48), 1267–1281 (2008).
21. Thway TM, et al. Impact of antidrug antibodies in preclinical pharmacokinetic assessment. J. Pharm. Biomed. Anal. 15(3), 856–862. (2013).
22. Cai XY, et al. Challenges of developing and validating immunogenicity assays to support comparability studies for biosimilar drug development. Bioanalysis 4(17), 2169–2177 (2012).

