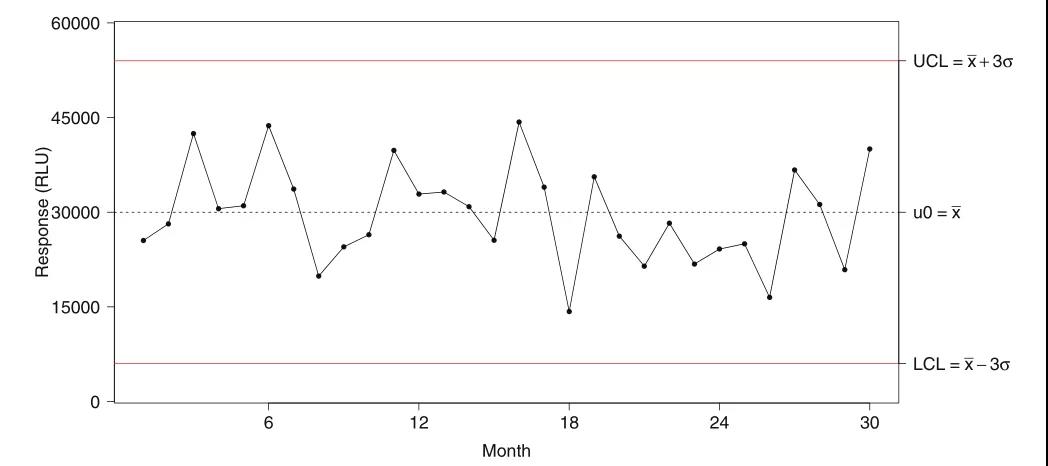
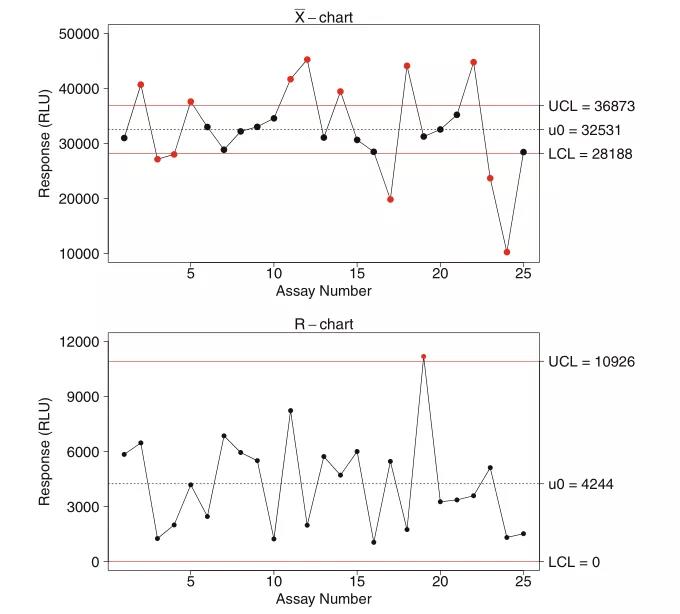
上周,“袁来如此”专栏初步介绍了LBA中的质量控制样品(QC,quality control)制备、认证(qualification)和批次一致性维护的相关概念和实践方法(袁来如此|大分子生物分析概论(八_上):LBA方法质量控制样品的制备和认证)。本期将延续上期内容,重点就监管机构对QC的要求、跟踪QC的效能趋势、防止分析漂移等方面做了详细解读。
“袁来如此”专栏系广州九游会J9医药微信公众号打造的科普学术专栏,内容均为九游会J9医药子公司深圳博瑞副总经理袁智博士原创。
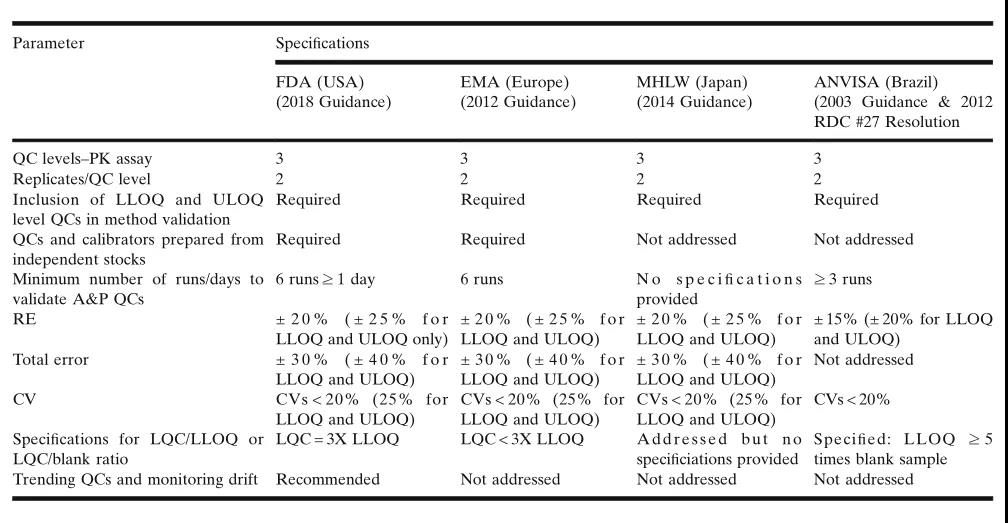
表3.监管机构对用于定量分析QC的要求之比较。